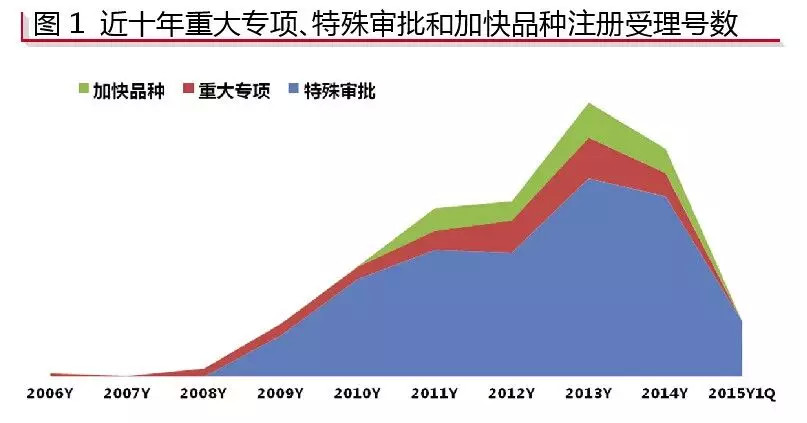
过去4年,国内企业对“特殊审批”、“重大专项”和“加快品种”三大通道的跟进度远远不及进口企业;但2015年第一季度,国产企业“特殊审批”受理号数量明显提升。
国家无疑是鼓励创新的,“重大专项”、“特殊审批”和“加快品种”三大通道正为创新药“开快车”。
根据咸达数据V3.1,“重大专项”早在2005年就有相关受理号;2004年“特殊审批”有相关受理号,但再一次有“特殊审批”标签的受理号就到2009年了;“加快品种”的受理号是从2010年开始的。
若统计2011~2014年三大通道的总受理号数,排名第一的是“特殊审批”,共914个;其次是“重大专项”,共168个;第三是“加快品种”,共147个(见图1)。值得注意的是,2015年第一季度,咸达数据V3.1截止至2015年4月10日监测数据显示,仅仅“特殊审批”就有相关注册受理号80个,但“加快品种”和“重大专项”没有受理号数据。
三大通道政策梳理
“特殊审批”
相对于申报生产的第三、四项,申报临床的第一、二项的门槛明显更低
“特殊审批”受理号数量那么多,或许与政策有相关。
按2009年1月7日颁布的《新药注册特殊审批管理办法》,享受特殊审批特殊待遇的药品有4种情形:一是未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂,新发现的药材及其制剂;二是未在国内外获准上市的化学原料药及其制剂、生物制品;三是治疗艾滋病、恶性肿瘤、罕见病等疾病且具有明显临床治疗优势的新药;四是治疗尚无有效治疗手段的疾病的新药。其中主治病证未在国家批准的中成药“功能主治”中收载的新药,可以视为尚无有效治疗手段的疾病的新药。
属于一、二项情形的,药品注册申请人可以在提交新药临床试验申请时提出特殊审批的申请,CDE应在收到特殊审批申请后5日内进行审查确定;属于三、四项情形的,申请人在申报生产时方可提出特殊审批的申请,CDE应在收到特殊审批申请后20日内组织专家会议进行审查确定。
相对于申报生产第三、四项,申报临床的第一、二项的门槛明显更低。2011~2014年,“特殊审批”申请注册号中,申报临床的有848个受理号,占比为92.8%,而申报生产的受理号仅为52个,补充的有14个,临床与生产报批的比例达到16:1。
“重大专项”
主要针对10类重大疾病,化学药、中药、生物药有各自的重点方向
重大新药创新专项属于国家重大科技专项,一向由卫计委推动,“十二五”期间任务是研制30个创新药物,改造200个左右药物大品种。2015年的重大新药创制科技重大专项,重点针对严重危害我国人民健康的恶性肿瘤、心脑血管疾病、神经退行性疾病、精神性疾病、糖尿病、自身免疫性疾病、耐药性病原菌感染、肺结核、重大病毒感染性疾病以及其他常见病和多发病(呼吸系统和消化系统疾病等)等10类(种)重大疾病。
其中,化学药主要针对神经精神系统疾病(BACE、AMPA等靶点)、代谢系统疾病(PCSK9等靶点)、肿瘤靶向及免疫治疗(WNT、PI3K-AKT-mTOR、c-Met、PD1、PD-L1、CTLA4、miRNA等靶点)、肺动脉高压及慢性阻塞性肺病(sGC等靶点)等新机制和新靶点。
中药则重点支持开展临床优势突出的创新中药的临床研究(近3年内获得临床试验批件,并已开展临床研究)。
生物药重点支持新结构抗体、双特异抗体、抗体偶联药物、全新结构蛋白及多肽药物、生物类似药;具备新技术、新工艺制备的新型疫苗、联合疫苗及治疗疫苗等,具备较好成药性的创新品种。
$:page
“加快品种”
目前暂无相关政策发布,从CDE标记有“加快品种”的产品看,疫苗占较大比例
至于“加快品种”,目前暂无相关政策发布。“加快品种”的政策主要是推进临床亟需仿制药优先审评制度建设。传说中有62个仿制药进行优先审评,但究竟是哪62个还是云里雾里。
从目前CDE标记有“加快品种”的产品来看,疫苗占了较大比例,如脊髓灰质炎相关疫苗、H7N9流感病毒相关疫苗、十三价肺炎球菌疫苗、麻疹疫苗、风疹疫苗等。
政策跟进能力PK
进口企业VS国内企业
三大通道吻合度:诺华NO.1,恒瑞NO.2,辉瑞NO.3
那么,“重大专项”、“特殊审批”和“加快品种”的注册受理号是否都属于国产厂家呢?
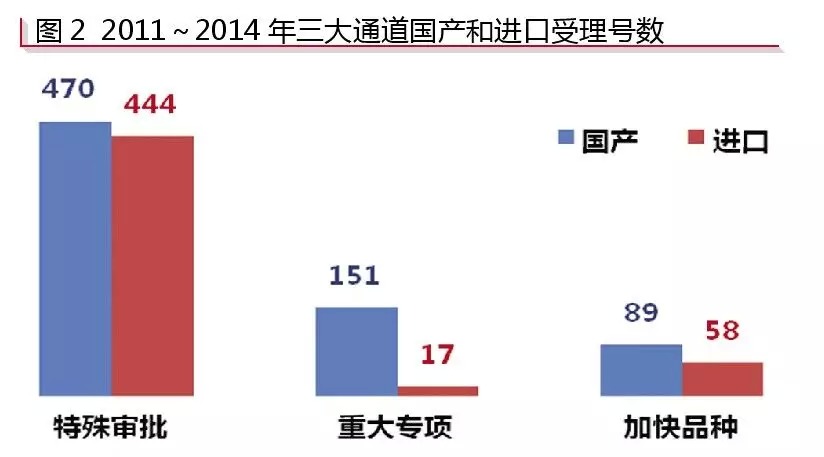
根据咸达数据V3.1的监测,“特殊审批”中,进口药品注册申报的较多,占比为48.58%,共444条受理号,其中97.97%为申报临床;“特殊审批”中,申报生产的国产受理号与进口受理号之比约为5:1;“加快品种”中,国产受理号与进口受理号之比为89:59;“重大专项”则更偏向于国产受理号,国产受理号与进口受理号的比约为9:1(见图2)。
一家企业如果能够非常娴熟地运用“重大专项”、“特殊审批”和“加快品种”等政策去申报注册产品,虽然未必能代表其创新能力,但一定能说明其非常适应国家的创新药鼓励政策。
如表1所示,三大通道受理号最多的生产企业是诺华,其次是恒瑞,第三位是辉瑞。前十一排名中,5个是国产企业,6个是进口企业。若不考虑“特殊审批”申报临床的数据,那么排名第一的是恒瑞,其次是豪森和天坛生物,第三是拜耳。
以上数据表明,实际响应国内创新药政策的国内企业并不多。相较于国内企业,国外企业更积极去适应国内的新药政策,以使自己的产品尽快上市。
国内企业开始觉醒
一季度,国内企业“特殊审批”提速,是进口企业的4倍
2011~2014年,恒瑞的受理号(除备案)共346条,属于三大通道的受理号共63条,占整体受理号数的18.21%;豪森的受理号(除备案)共299条,属于三大通道的受理号共63条,占整体受理号数的17.72%。
相较而言,同期科伦的受理号(除备案)共635条,但只有2个受理号属于“特殊审批”,且申报的是临床,尚无“重大专项”和“加快品种”的受理号。齐鲁受理号数为448条,有8个受理号属于“特殊审批”的临床申请,亦无“重大专项”和“加快品种”的受理号。科伦的申报受理号数是恒瑞的1.8倍,但恒瑞在三大通道的受理号数是科伦的32倍。
最近传闻,药品审批速度要加快了,以往积压的药品注册申请问题有望3年解决。假如产品批文获批速度加快,那么接下来就要开始面对多家生产企业的药品招标议价降价问题。在一众政策山雨欲来风满楼的层层压力之下,国内生产企业越来越关注创新药及其配套政策。
过去4年,国内生产企业实际申报的产品与国家三大通道政策的吻合度,远远不及进口企业。国内企业申报产品的策略更倾向于市场策略,应付招标政策。
可喜的是,国内企业已认识到变革迫在眉梢。2015年第一季度,国产企业“特殊审批”受理号数量是进口企业的4倍,这或许是我国创新药春天到来的一个信号。
提问:
国内完全自主研发的创新药有多少?
根据咸达数据V3.1,2014年1.1类化药9个受理号获批生产,涉及4个化学通用名,其中包括“阿德福韦酯”;3.1类化药70个受理号获批生产,5类26条,6类222条。2013年,1.1类获批的新药化药受理号有4个,涉及2个化学通用名,也包括“阿德福韦酯”,还有“帕拉米韦三水合物”;同年3.1类化药获批受理号95条,5类25条,6类223条。
若按照真正意义上的新化合物是我国自主研发才算创新药,那么我国的创新药和仿制药的比例恐怕会远低于1:100。